Was im Stahl für Ordnung sorgt
Kohlenstoffatome spielen für die Festigkeit von Stahl eine wichtige Rolle. Doch auch in Stählen, die schon seit Jahrzehnten im Einsatz sind, war das kollektive Verhalten dieser Atome bisher nicht vollständig verstanden. Eine gemeinsame Arbeit an der Ruhr-Universität Bochum (RUB) und dem Max-Planck-Institut für Eisenforschung (MPIE) in Düsseldorf hat Licht ins Dunkel gebracht: Das Wechselspiel zwischen den Kohlenstoffatomen, den durch sie verursachten Verzerrungen des Kristallgitters und den Gitterbaufehlern im Stahl ist für die energetischen Vorlieben der einzelnen Kohlenstoffatome entscheidend. Mit diesem Verständnis lässt sich die Herstellung von hochfesten Werkstoffen genauer steuern. Darüber berichtetr Nature Materials am 04.05.2020.
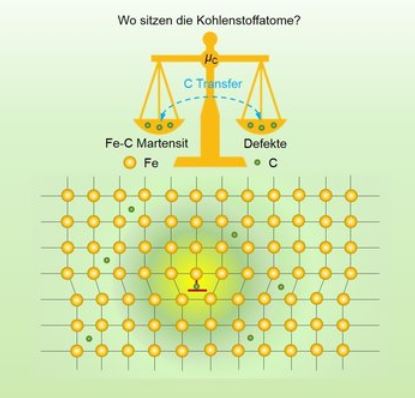
Die Verteilung und Anordnung der Kohlenstoffatome in martensitischem Stahl spielen eine wichtige Rolle für die Leistungsfähigkeit des Stahls. Das chemische Potenzial des Kohlenstoffs im System, das stark von der Kohlenstoffordnung im Gitter abhängt, bestimmt diese Verteilung. Während bei kleinen Kohlenstoffkonzentrationen die Bilanz zugunsten der Defekte ausfällt, werden bei größeren Konzentrationen bestimmte Gitterplätze energetisch bevorzugt (im Bild als gelbe Unterlegung dargestellt) – Grafik © Xie Zhang, Max-Planck-Institut für Eisenforschung GmbH
Wenn die Kohlenstoffkonzentration kippt
Die wichtigsten Bestandteile von Stahl sind die Elemente Eisen und Kohlenstoff. Entscheidend für die Festigkeit dieses Materials ist aber nicht in erster Linie das Mischungsverhältnis, sondern die Verteilung der Kohlenstoffatome. Nehmen sie nach der Stahlherstellung eine bestimmte Ordnung ein, sprechen Experten von Martensit (li.). Die Details der Bildung dieser Struktur gaben der Forschung allerdings jahrzehntelang Rätsel auf: Bis zu einer bestimmten Konzentration von Kohlenstoff sammeln sich die Kohlenstoffatome aus energetischen Gründen an Grenzflächen und Defekten im Gitter der Eisenatome an. Steigt die Kohlenstoffkonzentration über einen bestimmten Wert, findet sich der Überschuss der Kohlenstoffatome nicht mehr an solchen Defekten, obwohl dort eigentlich noch genug Platz wäre. Vielmehr verteilen sich die C-Atome ab dieser Konzentration auf eine bestimmte, geordnete Weise im Kristallgitter. „Dabei ist der Abstand der Kohlenstoffatome im Gitter eigentlich viel zu groß, um eine solche Ordnung chemisch zu begründen“, so Jutta Rogal vom Interdisciplinary Centre for Advanced Materials Simulation Icams der RUB.
Warum das so ist, hat das interdisziplinäre Team durch eine Kombination von theoretischen Berechnungen und Experimenten herausgefunden. Zwei Aspekte sind dafür von Bedeutung: Für das Kippen zwischen der Ansammlung von Kohlenstoffatomen an Defekten hin zu einem geordneten Aufsuchen bestimmter Plätze im Metallgitter sorgen stark anharmonische Verzerrungen der Gittermatrix in bestimmte kristallographische Richtungen. „Ist die Kohlenstoffkonzentration zu gering für starke Verzerrungen, ist es energetisch am wenigsten aufwändig, Grenzen oder Defekte zu besetzen“, erklärt Tilmann Hickel vom Max-Planck-Institut für Eisenforschung (MPIE) und vom ICAMS. „Ab einer gewissen Konzentration stellt sich aber ein kollektiver Effekt der Atome ein, weil dieser Zustand mit einer Absenkung des chemischen Potenzials einhergeht – was den Gesetzen der Thermodynamik nach einer Energieminimierung entspricht.“
Gesamtsystem und einzelne Teile
Will man also die Prozesse der Werkstoffherstellung steuern, muss man diese Grundlagen in ihren komplexen Zusammenhängen kennen. „Wir müssen die Energie des gesamten Systems als Funktion von Druck und Temperatur im Auge haben, aber gleichzeitig auch die Energetik des einzelnen Teilchens in diesem System“, fasst Prof. Jörg Neugebauer vom MPIE zusammen. Nur so ist es dem Forschungsteam gelungen, die theoretischen Vorhersagen mit in Experimenten gemessenen Daten in Einklang zu bringen. Für die Messungen an verschiedenen Werkstoffen kamen die Atomprobentomografie und die Transmissionselektronenmikroskopie zum Einsatz.
->Quelle:
- mpie.de/carbon-interstitials-in-steels-nature-materials
- icams.de/content/news/?detail=271
Originalveröffentlichung: Xie Zhang, Hongcai Wang, Tilmann Hickel, Jutta Rogal, Yujiao Li, Jörg Neugebauer: Mechanism of collective interstitial ordering in Fe–C alloys, in: Nature Materials, 2020, DOI: 10.1038/s41563-020-0677-9, https://www.nature.com/articles/s41563-020-0677-9