Photosynthetischer Komplex I ist Schlüsselelement im photosynthetischen Elektronentransport – bislang wenig über ihn bekannt
 Ein internationales Team von Wissenschaftlern aus verschiedenen universitären und außeruniversitären Forschungseinrichtungen hat die Struktur und Funktionsweise des photosynthetischen Komplex I aufgeklärt. Der Membranproteinkomplex ist wesentlicher Bestandteil der Photosynthese und spielt eine wichtige Rolle in der dynamischen Anpassung von Elektronentransportprozessen. Die Arbeit des Teams von 14 Kooperationspartnern, zu denen neben Hauptautor Prof. Marc Nowarcyk von der Ruhr-Universität Bochum auch James Birrell und Prof. Wolfgang Lubitz vom MPI CEC in Mülheim/Ruhr und Nicholas Cox von der Australian National University (ANU) in Canberra gehören, wurde im Januarheft der Zeitschrift Science veröffentlicht.
Ein internationales Team von Wissenschaftlern aus verschiedenen universitären und außeruniversitären Forschungseinrichtungen hat die Struktur und Funktionsweise des photosynthetischen Komplex I aufgeklärt. Der Membranproteinkomplex ist wesentlicher Bestandteil der Photosynthese und spielt eine wichtige Rolle in der dynamischen Anpassung von Elektronentransportprozessen. Die Arbeit des Teams von 14 Kooperationspartnern, zu denen neben Hauptautor Prof. Marc Nowarcyk von der Ruhr-Universität Bochum auch James Birrell und Prof. Wolfgang Lubitz vom MPI CEC in Mülheim/Ruhr und Nicholas Cox von der Australian National University (ANU) in Canberra gehören, wurde im Januarheft der Zeitschrift Science veröffentlicht.
Biologische Stromkreise
Der sogenannte Komplex I ist in fast allen lebenden Organismen zu finden. In Pflanzenzellen kommt er in zwei Varianten vor: Einmal im Mitochondrium, dem Kraftwerk der Zelle, und einmal in den Chloroplasten. In beiden Fällen ist der Komplex I Teil einer Elektronentransportkette, die als biologische Version eines elektrischen Stromkreises betrachtet werden kann. Diese biologischen Stromkreise treiben die molekularen Maschinen der Zelle an, die letztendlich dafür verantwortlich sind, Energie umzuwandeln und zu speichern. Die Struktur und Funktion des mitochondrialen Komplex I als Komponente der Zellatmung ist bereits gut untersucht, während die zweite Variante, der photosynthetische Komplex I, bislang wenig erforscht wurde.
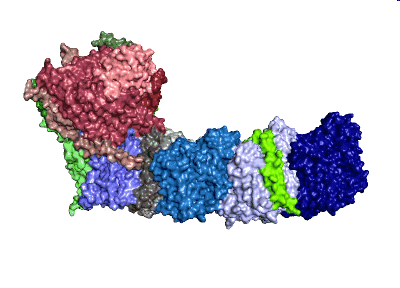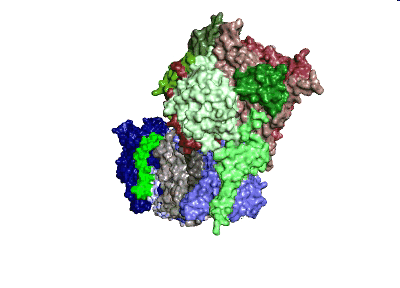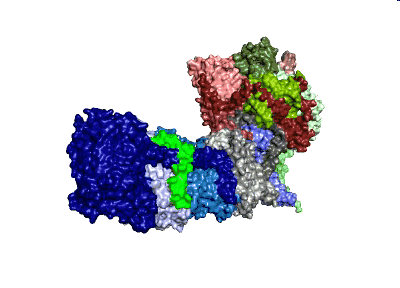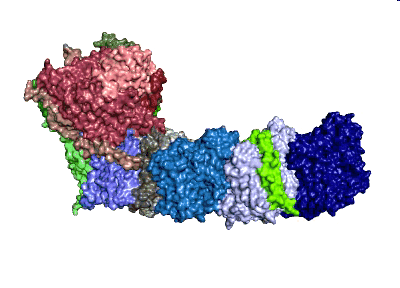
Modell: MPI CEC
Photosynthese kurzgeschlossen
Mittels Kryoelektronenmikroskopie, ein bildgebendes Verfahren zur Darstellung kleinster Zellstrukturen, stellten die ForscherInnen erstmals die molekulare Struktur des photosynthetischen Komplex I dar. Sie zeigten, dass die Struktur wesentliche Unterschiede zur mitochondrialen Variante aufweist. Zusätzliche Einblicke erlangten die Wissenschaftler des MPI CEC und der ANU durch die Untersuchung sogenannter Eisen-Schwefel-Cluster, die auch Elektronen transportieren. “Die Natur nutzt Eisen-Schwefel-Cluster, um natürliche Stromkreise zu bauen” sagt Professor Wolfgang Lubitz, der Leiter des Teams am MPI CEC. “Im Komplex I werden Elektronen von einer Seite des Enzymes zur anderen transportiert. Dabei ist der Leitungsweg im photosynthetischen Komplex I deutlich kürzer als im mitochondrialen Komplex I, was wichtig für die Funktion ist.” So wurde deutlich, dass der für den Elektronentransport verantwortliche Teil im photosynthetischen Komplex I optimierte Strukturen für den zyklischen Elektronentransport aufweist.
Durch diesen molekularen Kurzschluss werden Elektronen zurück in die photosynthetische Elektronentransportkette eingespeist anstatt gespeichert zu werden. Bei der Nachbildung des Vorgangs im Reagenzglas zeigte sich, dass das eisen- und schwefelhaltige Protein Ferredoxin eine zentrale Rolle spielt. Mit spektroskopischen Methoden wiesen Prof. Lubitz, Birrell, Cox und ihre Mitarbeiter nach, dass der Elektronentransfer vom Ferredoxin auf den Komplex I höchst effizient abläuft.
Molekulare Angel
Im nächsten Schritt analysierte die Gruppe, welche Strukturelemente auf molekularer Ebene für diese effiziente Interaktion verantwortlich sind. Dabei konnten sie zeigen, dass Komplex I einen besonders flexiblen Teil in seiner Struktur besitzt, der Ferredoxin wie mit einer Angel einfängt. Dadurch gelangt Ferredoxin in die optimale Bindeposition für die Elektronenübergabe. „Somit konnten wir die Struktur mit der Funktion des photosynthetischen Komplex I zusammenbringen und einen detaillierten Einblick in die molekularen Grundlagen der Elektronentransportvorgänge erhalten“, resümiert Nowaczyk, der Hauptautor der Studie. „In Zukunft wollen wir auf dieser Basis künstliche Elektronentransportketten erschaffen, die neue Anwendungen im Bereich der Synthetischen Biologie ermöglichen sollen.“
Beteiligte Institutionen und Förderung
Max Planck Institut für Biochemie, Max Planck Institut für Chemische Energiekonversion, Yokohama City University, Australian National University, Ludwig-Maximilians-Universität München, Université Paris-Saclay, Osaka University, Ruhr-Universität Bochum.
Die Deutsche Forschungsgemeinschaft unterstützte die Studie im Rahmen des Exzellenzclusters Resolv (EXC 1069), der Forschungsgruppe FOR2092 (EN 1194/1-1 und NO 836/3-2), des Schwerpunktprogramms 2002 (NO 836/4-1) sowie des Projekts NO 836/1-1. Weitere Förderung kam von der Max-Planck-Gesellschaft, dem Australian Research Council (FT140100834, N.C.), JST-CREST (JPMJCR13M4, G.K.), MEXT-KAKENHI (16H06560, G.K.), der French Infrastructure for Integrated Structural Biology (FRISBI ANR-10-INSB-05) und dem International Joint Research Promotion Program der Osaka University.
->Quellen:
- mpg.de/struktur-und-funktion-von-photosyntheseprotein-im-detail-aufgeklaert
- cec.mpg.de/de/aktuelles/detailansicht/struktur-und-funktion-von-photosyntheseprotein-im-detail-aufgeklaert
- Pressemitteilung der Ruhr Universität Bochum
- Originalveröffentlichung Jan. M. Schuller et al.: Structural adaptations of photosynthetic complex I enable ferredoxin-dependent electron transfer, in: Science, 2018, DOI: 10.1126/science.aau3613