CEC: Erstmalige Charakterisierung einer sensorischen [FeFe]-Hydrogenase gelungen – wichtige Hinweise für angewandte Katalyse-Forschung entdeckt
Hydrogenasen sind Enzyme, die Wasserstoffgas (H2) aus Protonen im wässrigen Milieu erzeugen können. Bakterien mit diesen Enzymen produzieren H2 häufig als Abfallprodukt ihres zuckerbasierten Metabolismus in Abwesenheit von Sauerstoff. Andere Bakterien können den Wasserstoff als Energiequelle nutzen. Jetzt ist es einem Team von Wissenschaftlern am Max-Planck-Institut für Chemische Ernergiekonversion (CEC) in Mülheim an der Ruhr und dem Institute of Low Temperature Science an der University of Hokkaido (Japan) ein entscheidende Fortschritt gelungen. Ein weiteres Team des CEC und der Ruhr-Universität Bochum analysierte kurz zuvor speziell die Rolle von Wasserstoffbrücken-Bindungen in bestimmten Enzymen aus Grünalgen, den Hydrogenasen. Denn das Zusammenspiel von Proteinhülle und aktivem Zentrum in Wasserstoff produzierenden Enzymen ist entscheidend für die Effizienz der Biokatalysatoren.
1. [FeFe]-Hydrogenasen (HydS)
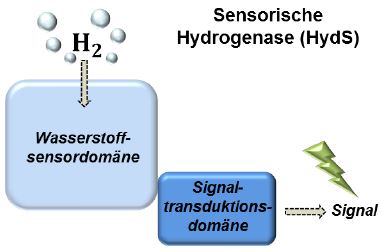
Sensorische Hydrogenase HydS – Grafik © CEC
Hydrogenasen, die Schlüsselenzyme in beiden Prozessen, sind nur unter speziellen Bedingungen erforderlich, d.h. ihre Synthese in dem Bakterium muss der Anwesenheit und Konzentration von H2 angepasst werden. Diese Regulation wird durch sogenannte sensorische oder regulatorische Hydrogenasen erreicht, die in der Lage sind, selbst kleinste Mengen von H2 im Medium zu detektieren und diese Information an die Protein-Synthesemaschinerie (für katalytische Hydrogenasen) weiterzuleiten.
Enzym-Maturierung
Bis heute hat sich eine Klasse von Sensor-Hydrogenasen der Charakterisierung komplett entzogen, nämlich die der wichtigen [FeFe]-Hydrogenasen (HydS). Jetzt ist es einem Team von Wissenschaftlern am Max-Planck-Institut für Chemische Ernergiekonversion in Mülheim an der Ruhr und dem Institute of Low Temperature Science an der University of Hokkaido (Japan) gelungen, HydS aus dem thermophilen Bakterium Thermotoga maritima herzustellen und zu charakterisieren. Dieser Erfolg – veröffentlicht im Journal of the American Chemical Society – basiert auf der kürzlich entwickelten Technik der künstlichen Maturierung des Enzyms (Esselborn et al. Nat. Chem. Biol. 2013), sowie dem Einsatz moderner spektroskopischer Methoden, die zeigten, wie das Protein das katalytische Zentrum in eleganter Weise feinabstimmt und es dadurch für seine sensorische Funktion optimiert.
Katalytisches Zentrum detektiert sehr empfindlich auch kleinste Mengen H2
Die Wissenschaftler zeigen, dass das katalytische Zentrum sehr empfindlich auch kleinste Mengen H2 detektiert, was dem Bakterium eine sehr effektive Signalübertragung erlaubt. Diese Ergebnisse stellen einen wesentlichen Schritt im Verständnis der Funktion der sensorischen Hydrogenasen dar. Die Kenntnis der Änderungen der Aminosäureumgebung im Sensor im Vergleich zu den katalytischen [FeFe]-Hydrogenasen ist ein wichtiges Element für das tiefere Verständnis dieser Wasserstoff umsetzenden bzw. erzeugenden Proteine. Die umfassende Entschlüsselung des Mechanismus der Hydrogenasen bietet die Grundlage, um bessere bioinspirierte Katalysatoren für den Einsatz in Brennstoffzellen und Wasserelektrolyseuren zu entwickeln. Ein wichtiger Schritt auf dem Weg zu einer Energiewirtschaft, die auf Wasserstoff als Energieträger basiert.
2. Proteinumfeld macht Katalysator effizient
Biokatalysatoren sind große Proteinmoleküle. Die eigentliche Reaktion findet dabei nur an einem kleinen Herzstück statt. Der Rest spielt aber auch eine Rolle. Das Zusammenspiel von Proteinhülle und aktivem Zentrum in Wasserstoff produzierenden Enzymen ist entscheidend für die Effizienz der Biokatalysatoren. Ein CEC-Team und Kollegen der Ruhr-Universität Bochum analysierten speziell die Rolle von Wasserstoffbrückenbindungen in bestimmten Enzymen aus Grünalgen, den Hydrogenasen. Die Gruppen, die im Exzellenzcluster Resolv kooperieren, veröffentlichten die Ergebnisse ebenfalls im Journal of the American Chemical Society.
„Die Erkenntnisse tragen nicht nur zum Verständnis dieser weltweit beachteten Biokatalysatorgruppe bei, sondern geben der angewandten Forschung zusätzlich wichtige Hinweise für die Entwicklung chemischer Katalysatoren nach Vorbild des hochaktiven Biomoleküls“, sagt Dr. Martin Winkler von der Bochumer Arbeitsgruppe Photobiotechnologie.
Leistungsfähigste Biokatalysatoren
Die Forscher untersuchten [FeFe]-Hydrogenasen. Sie bestehen aus einem Proteingerüst und einem aktiven Zentrum, H-Cluster genannt. Letzterer besteht aus sechs Eisen- und sechs Schwefelatomen sowie aus sechs ungewöhnlichen Bausteinen. Er bildet den Ort, an dem die eigentliche Wasserstoffsynthese aus Protonen und Elektronen stattfindet. „[FeFe]-Hydrogenasen gehören zu den leistungsfähigsten Biokatalysatoren überhaupt“, erklärt Prof. Dr. Thomas Happe, Leiter der Arbeitsgruppe Photobiotechnologie. Die Kommunikation zwischen H-Cluster und Proteinumgebung spielt dabei eine entscheidende Rolle.
Sie hilft bei der gezielten Anlieferung der Ausgangsstoffe für die Synthese und beim effizienten Abtransport des Produkts. „Außerdem sorgt die Proteinhülle für eine optimale räumliche Ausrichtung des H-Clusters und schützt ihn vor schädigenden Einflüssen“, ergänzt Oliver Lampret, der seine Doktorarbeit zu diesem Thema schreibt.
Manipulation der Wasserstoffbrücken
Die Bochumer Gruppe und ihre Mülheimer Kollegen Dr. Agnieszka Adamska-Venkatesh, Dr.Olaf Rüdiger und Prof. Dr. Wolfgang Lubitz zeigten, dass die Wasserstoffbrückenbindungen zwischen H-Cluster und Proteinumfeld die elektrochemischen Eigenschaften des aktiven Enzymzentrums maßgeblich beeinflussen. Sie entfernten einzelne Wasserstoffbrücken oder fügten zusätzliche hinzu und untersuchten die Effekte.
Die Manipulation veränderte sowohl die Elektronentransporteigenschaften des Enzyms als auch die katalytische Richtung, in die es arbeitet; denn Hydrogenasen können sowohl Wasserstoff produzieren als auch die umgekehrte Reaktion katalysieren, also die Spaltung von Wasserstoff in Protonen und Elektronen. Den Einfluss der Wasserstoffbrücken belegten die Wissenschaftler mit drei verschiedenen Methoden: spektroskopisch, elektrochemisch und enzymkinetisch.
->Quellen:
- cec.mpg.de/potenzial-fuer-eine-gruene-wasserstoff-wirtschaft
- Nipa Chongdar, James A. Birrell, Krzysztof Pawlak, Constanze Sommer, Edward J. Reijerse, Olaf Rüdiger, Wolfgang Lubitz, Hideaki Ogata: Unique spectroscopic properties of the H-cluster in a putative sensory [FeFe] hydrogenase,in: Journal of the American Chemical Society, 2017, DOI: 10.1021/jacs.7b11287- http://pubs.acs.org/doi/10.1021/jacs.7b11287
- cec.mpg.de/171214_H2_Produktion – Fortschritte_in_Katalyseforschung_MPICEC_RUB.pdf
- Oliver Lampret, Agnieszka Adamska-Venkatesh, Hannes Konegger, Florian Wittkamp, Ulf- Peter Apfel, Edward J. Reijerse, Wolfgang Lubitz, Olaf Rüdiger, Thomas Happe, Martin Winkler: Interplay between CN– ligands and the secondary coordination sphere of the H-cluster in [FeFe]-hydrogenases, Journal of the American Chemical Society, 2017, DOI: 10.1021/jacs.7b08735 http://pubs.acs.org/doi/abs/10.1021/jacs.7b08735