Neues über Wasserspaltung in natürlicher Photosynthese
Ein internationales Forschungsteam, darunter das  Mülheimer Max-Planck-Institut für Chemische Energiekonversion (MPI CEC) und die
Mülheimer Max-Planck-Institut für Chemische Energiekonversion (MPI CEC) und die  Australian National University (ANU), hat am 07.08.2019 Ergebnisse zum Ablauf der Wasserspaltung in der natürlichen Photosynthese publiziert, ein Prozess von fundamentaler Bedeutung für das Leben auf der Erde. Die erzielten Ergebnisse sind auch wichtig für die Entwicklung von CO2-freien solaren Brennstoffen.
Australian National University (ANU), hat am 07.08.2019 Ergebnisse zum Ablauf der Wasserspaltung in der natürlichen Photosynthese publiziert, ein Prozess von fundamentaler Bedeutung für das Leben auf der Erde. Die erzielten Ergebnisse sind auch wichtig für die Entwicklung von CO2-freien solaren Brennstoffen.
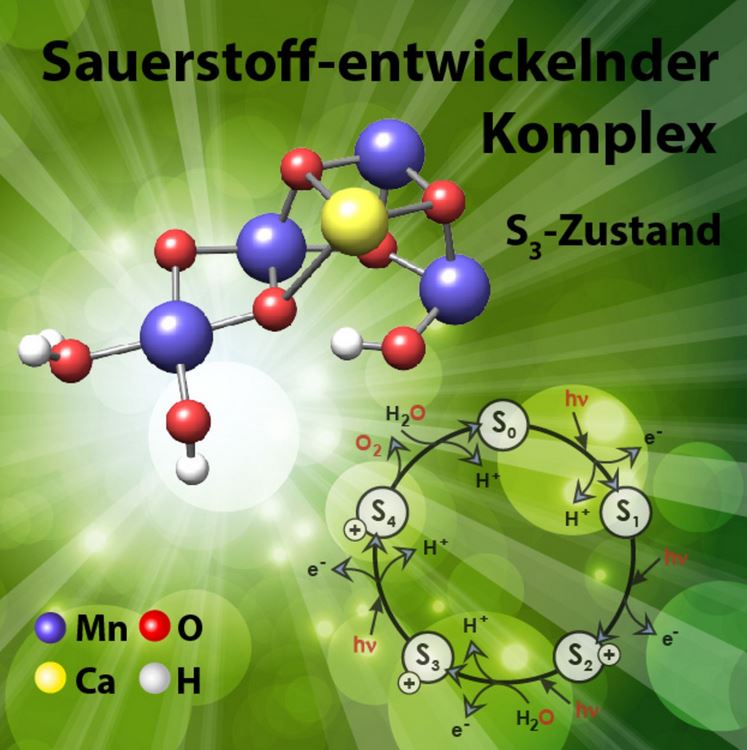
Studie zeigt Aktivierung des Komplexes und kontrollierte Wasseraufnahme aus der Umgebung des Proteins – Grafik © MPI-CEC
Die Oxidation von zwei Wassermolekülen zu molekularem Sauerstoff mittels Sonnenlicht ist einer der ersten Schritte der sogenannten oxygenen Photosynthese, ein Prozess, der in allen Pflanzen, Algen und Cyanobakterien abläuft. Die Reaktion ähnelt der Lichtumwandlung in Photovoltaikanlagen. Allerdings werden hier anstelle von Elektrizität energiereiche chemische Verbindungen erzeugt, Kohlenhydrate, die uns dann als Nahrung und in fossiler Form als Brennstoffe (Öl, Gas, Kohle) zur Verfügung stehen. Durch die Freisetzung von Sauerstoff hat die Photosynthese auch unsere sauerstoffreiche Erdatmosphäre erzeugt sowie die Ozonschicht in der Stratosphäre, welche uns vor der harten UV-Strahlung der Sonne schützt.

Nick Cox – Foto © MPI CEC
Die Untersuchungen unter der Leitung von Nick Cox, ehemaliger Gruppenleiter in der Abteilung von Prof. Wolfgang Lubitz am MPI CEC konzentrierten sich auf ein für die biologische Wasserspaltung verantwortliches photosynthetisches Enzym. Die Reaktion läuft im sogenannten Photosystem II ab – an einem Metallcluster aus vier Mangan- und einem Kalzium-Metall-Ion. Dieser Komplex bindet zwei Wassermolekülean benachbarten Zentren, die nach Oxidation und Protonenabgabe ein Sauerstoffmolekül bilden und freisetzen. Die Studie zeigt, wie dieser Komplex aktiviert wird und die kontrollierte Aufnahme von Wasser aus der Umgebung des Proteins abläuft. „Unsere Ergebnisse zeigen, dass das Enzym atmet, um die Wassermoleküle aufzunehmen“, sagt Cox. „Auf halben Weg durch den Reaktionszyklus beginnt das Enzym sich zu dehnen wie eine Ziehharmonika und ermöglicht damit die Bindung eines Wassermoleküls an den Mangan-Cluster.“

Maria Chrysina – Foto © MPI CEC
Wichtig ist dabei, dass diese Bewegung an anderen Stellen des Reaktionszyklus nicht möglich ist, was eine Wasseraufnahme verhindert. Das ist die Basis der hochspezifischen Bildung eines Sauerstoffmoleküls aus zwei Wassermolekülen. „Ohne die genaue sequenzielle Bindung und Umsetzung der beiden Wassermoleküle am Mangan-Cluster würden sich in dem Prozess leicht agressive Zwischenstufen des Sauerstoffs bilden (sogenannte reaktive Sauerstoffspezies), die mit dem Protein reagieren und dieses zerstören,“ sagt Maria Chrysina vom MPI CEC.

Prof. Wolfgang Lubitz, CEC – Foto © Solarify
Falls es gelingt, die Wasserspaltung im Labor mit ähnlicher Effizienz wie in der Natur nachzuahmen, würde der Menschheit damit eine unerschöpfliche nachhaltige Energiequelle zur Verfügung stehen. „Die Energie des Sonnenlichts, die in einer Stunde auf die Erdoberfläche fällt, reicht aus, um den momentanen Energiebedarf der gesamten Menschheit für ein ganzes Jahr zu decken“ sagt Prof. Wolfgang Lubitz, Direktor emeritus am MPI CEC.
Die Entwicklung eines artifiziellen wasserspaltenden Enzyms würde es erlauben, “solare Brennstoffe” zu erzeugen, eine grüne Alternative zu Benzin, Diesel und Erdgas. Ein solcher solarer Brennstoff wäre z. B. Wasserstoff, der ohne Abgabe des Klimagases CO2 verbrennt. Wasserstoff aus der Spaltung von Wasser könnte dann auch für die Darstellung anderer wichtiger Chemikalien eingesetzt werden, z. B. für die Synthese von Düngemitteln in der Agrarwirtschaft – essenziell für die Lebensmittelversorgung der Weltbevölkerung.
Die Untersuchungen basieren auf einer spektroskopischen Technik (electron paramagnetic resonance, EPR, oder Elektronenspinresonanz, ESR) , die zur Untersuchung magnetischer Materialien und auch für Metallzentren in biologischen Molekülen eingesetzt wird. Diese Technik liefert Informationen zur elektronischen Struktur eines katalytischen Zentrums, z.B. eines Metallo-Enzyms auf molekularer Ebene, wie im wasserspaltenden Enzym der Photosynthese.
Cox leitet die Einrichtung einer neuen hochmodernen EPR-Anlage an der ANU mit Unterstützung des Australian Research Council (ARC), der University of New South Wales, der University of Queensland, der University of Sydney und der University of Wollongongong. „Diese neue Anlage wird mit viel stärkeren Magnetfeldern arbeiten als heute, so dass detailliertere Messungen für die medizinische, biologische, chemische und Materialforschung sowie für industrielle Anwendungen möglich sind“, sagte er.
Die Ergebnisse wurden erzielt durch eine Zusammenarbeit von Wissenschaftlern aus den Max-Planck-Instituten für Chemische Energiekonversion (MPI CEC) und für Kohlenforschung (MPI KOFO) in Mülheim/Ruhr, der Ruhr-Universität Bochum, der Universität in Uppsala (Schweden) und der Australischen Nationalen Universität (ANU) in Canberra. Die Arbeit ist kürzlich erschienen in Proceedings of the National Academy of Sciences of the United States of America.
->Quellen:
- cec.mpg.de/wie-die-natur-wasser-spaltet-und-den-planeten-mit-energie-versorgt
- anu.edu.au/nature-offers-potential-for-endless-renewable-fuel-supplies
- Chrysina, M., Heyno, E., Kutin, Y., Reus, M., Nilsson, H., Nowaczyk, M. M., DeBeer, S., Neese, F., Messinger, J., Lubitz, W., Cox, N. (2019). Five-coordinate MnIV intermediate in the activation of nature’s water splitting cofactor in: Proceedings of the National Academy of Sciences Aug 2019, 201817526; DOI: 10.1073/pnas.1817526116